Teori Struktur Atom Berdasarkan Para Mahir Beserta Pengertiannya (Lengkap)
Struktur Atom – Salah satu pelajaran Fisika yang menarik ialah mempelajari teori atom. Dalam hal ini, teori atom juga termasuk salah satu materi dasar yang merupakan sumber untuk sanggup mengenal Fisika lebih dalam lagi. Untuk menambah pengetahuan dan mengenal struktur atom lebih dalam lagi, berikut ialah klarifikasi mengenai hal-hal yang terkait dengan struktur atom.
Daftar Isi Artikel
Pengertian Struktur Atom
Atom ialah bahasa yang berasal dari bahasa Yunani, yaitu “Atomos”. Kata Atom sendiri mempunyai arti “tidak sanggup dibagi”. Democritus ialah orang Yunani pertama yang mengemukakan konsep dasar dari atom di awal kala ke-4 sebelum masehi. Dalam hal in, Democritus mengungkapkan bahwa atom ialah benda sanggup dibagi menjadi beberapa bab yang sangat kecil hingga jadinya tidak sanggup dibagi.
Teori atom ini juga menyampaikan bahwa atom tidak mempunyai bentuk yang sepenuhnya padat, namun atom sendiri mempunyai struktur internal yang mempunyai ruang kosong antara atom untuk pergerakan yang akan di lakukannya. Hal ini yang menciptakan atom sanggup bergerak dalam air dan udara, bahkan mempunyai gerakan yang fleksibilitas dalam bentuk beda padat.
Atom sendiri juga sanggup dibedakan dalam bentuk, masa dan juga ukurannya. Dalam hal ini, atom juga mempunyai perbedan dari sifat dan bagaimana materialnya. Untuk model yang dibentuk oleh Democritus sendiri, dijelaskan bahwa atom ialah benda yang semua bentuknya mempunyai ukuran yang kecil. Namun teori ini belum mempunyai bukti eksperimental yang berpengaruh sehingga masih muncul teori baru.
Pada tahun 1800an yang menciptakan teori-teori mengenai atom jadinya muncul dengan didasarkan eksperimen yang dilakukan. Hal ini juga yang menciptakan atom dikenal sebagai satuan kecil sebuah materi yang mana sanggup berupa benda beragam, menyerupai cair, padat dan juga gas. Atom sendiri merupakan bentuk dari materi dasar yang membentuk sebuah materi hingga ke bentuk yang sanggup di rasakan.
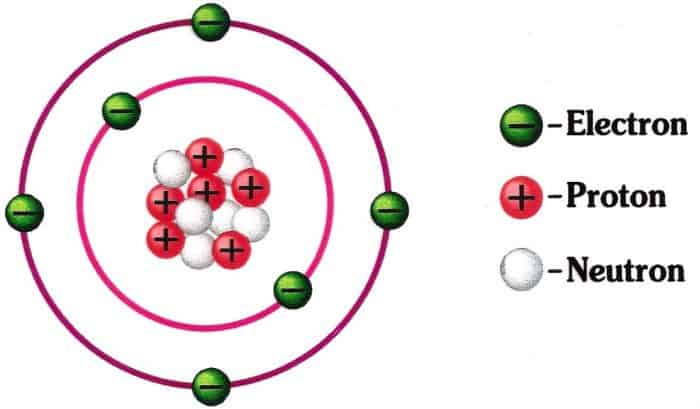
Materi tersebut menyerupai gas dan juga angin, untuk benda atom sanggup berupa menyerupai air, kayu dan juga handphone. Struktur atom sendiri terdiri atas 3 inti materi, yaitu elektron, proton dan juga neutron. Ketiga ini ialah inti yang berada dalam inti atom. Namun elektron ialah bab inti yang mengelilingi atom menyerupai proton dan juga neutron.
Ketiga struktur atom ini mempunyai muatan yang berbeda. Proton mempunyai struktur atom yang bermuatan positif, neutron untuk muatan netral dan juga elektron yang bermuatan negatif. Hal ini juga yang menciptakan struktur atom berada dalam sistem periodik yang dipengaruhi oleh daya tarik elektron, proton dan neutron.
Struktur Atom John Dalton

Pada tahun 1803, John Dalton pertama kali mengemukakan pendapatnya mengenai struktur atom. Dalam hal ini, tentunya teori yang dikemukakakn oleh Dalton didasarkan pada dua hukum, yaitu aturan susunan tetap atau yang lebih dikenal dengan aturan prouts dan aturan kekekalan masa atau aturan Lavoisier.
Kedua aturan ini mempunyai pernyataan yang berbeda, dimana untuk Lavosier menyatakan, “reaksi akan selalu sama dengan masa total zat-zat engan masa total zat hasil dari reaksi”. Sedangkan untuk prouts menyatakan bahwa, “setiap perbandingan yang dimiliki oleh unsur dalam suatu senyawa akan selalu tetap”. Dari kedua teori ini, maka Dalton menyimpulkan struktur atom bahwa :
- Atom ialah salah satu bab yang paling kecil yang dimiliki materi dan tidak sanggup untuk dibagi
- Atom sanggup digambarkan sebagai salah satu bola pejal yang berukuran kecil
- Atom bergabung dengan senyawa lainnya dengan perbandingan untuk bilangan lingkaran dan mempunyai bentuk sederhana
Kelebihan struktur atom Dalton:
Membangkitkan cita-cita untuk para peneliti untuk melaksanakan penelitian lebih jauh mengenai model atom
Kelemahan struktur atom Dalton:
Teori ini ialah salah satu teori yang mana tidak sanggup menawarkan kejelasan mengenai larutan yang sanggup menghantarkan listrik.
Struktur Atom JJ.Thomson

Teori ini dikemukakan oleh salah satu peneliti berjulukan JJ.Thomson. Thomson menyampaikan pendapatnya bahwa atom sendiri mempunyai dua partikel yang berjulukan elektron dan juga proton. Dalam hal ini Thomson juga melaksanakan eksperimen yang menghasilkan bahwa proton mempunyai masa yang lebih besar dibandingkan dengan elektron, inilah yang menciptakan Thomsosn menggambarkan atom sebagai proton.
Namun di dalam proton sendiri, adanya elektron mempunyai fungsi untuk menawarkan nilai neral terhadap positif dari proton. Kesimpulan didapatkan bahwa Thomson, beropini bahwa atom ialah bola pejal positif namun mempunyai muatan negatif yang tersebar di dalamnya. Struktur atom yang di kemukakakn oleh Thomson ini mempunyai kelebihan dan kekurangan.
Kelebihan struktur atom J.J Thomson:
Dapat menawarkan bukti bahwa adanya partikel lainnya yang juga mempunyai nilai negatif. Hal ini juga muncul kesimpulan bahwa atom bukan merupakan satu-satunya bab yang paling kecil dari suatu unsur.
Kelemahan struktur atom J.J Thomson:
Model ini tidak sanggup menjelaskan secara rinci mana yang merupakan susunan positif dan negatif dari bola tersebut. Hal ini tentunya akan memudahkan perhitungan yang akan di lakukan untuk penghitungan model atom.
Struktur Atom Rutherford
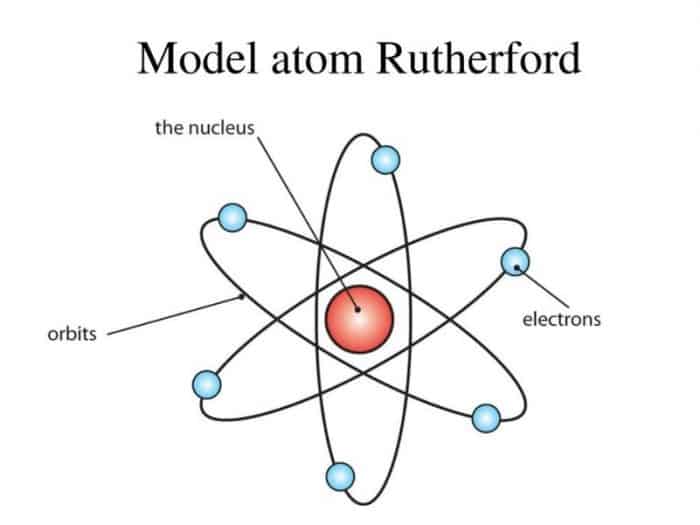
Struktur atom ini mulai dikemukakan oleh Rutherford. Namun beliau tidak sendiri, melainkan bersama dengan kedua muridnya dan melaksanakan percobaan dengan hamburan sinar alfa terhadap lempeng tipis emas. Dalam percobaan yang dilakukannya, dihaslilkan kesimpulan bahwa partikel alfa sanggup menembus lembaran emas tanpa adanya belokkan.
Bukan hanya itu, Rutherford juga menemukan partikel alfa lainnya yang dibelokkan sedikit dan menawarkan hasil yang cukup mengejutkan, yaitu partikel alfa tersebut kembali pribadi menuju sumber radioaktif. Dalam hal ini, untuk menawarkan dan melihat lebih jauh lagi Rutherford melaksanakan uji coba dengan mengemabngkan model inti atom.
Dengan percobaan yang dilakukannya, kesimpulan yang di sanggup yaitu Atom bukanlah merupakan bola pejal., dikarenakan hampir semua partikel alfa diteruskan. Kesimpulan lainnya yaitu lempengan emas yang ada dianggap sebagai satu lapisan atom emas yang mana mempunyai partikel atom yang sangat kecil dengan muatan posiif.
Kesimpulan terakhir yaitu bahwa partikel tersebutlah yang menyusun inti dari atom. Hal ini tentunya di dasarkan dengan fakta dimana 20.000 partikel alfa yang ada akan dibelokkan. Dari kesimpulan yang didapat, Rutherford yakin bahwa atom sendiri terdiri dari inti atom yang mana mempunyai ukuran sangat kecil dan muatan yang ada positif, namun dikelilingi oleh muatan negatif.
Kelebihan struktur atom Rutherford:
Atom ialah salah susunan dari inti atom dan juga elektron yang mana mengelilimgi inti. Mengelilingi inti ini juga merupakan gerakan yang mana menawarkan pandangan gres pada inovasi gres lainnya yaitu perihal lintasan atau kedudukan elektron yang lebih dikenal sebagai kulit elektron.
Kekurangan struktur atom Rutherford:
Belum ada klarifikasi yang niscaya mengenai bagaimana elektron sanggup jatuh ke dalam inti atom. Dalam hal ini, jikalau di dasarkan dengan teori gerak, maka elektron mengitari inti bersamaan dengan pemancarana energi yang akan lama. Hal ini akan menciptakan energi dari elektron berkurang dan makin usang akan mendekati inti dan jatuh kedalamnya.
Model Atom Niels Bohr
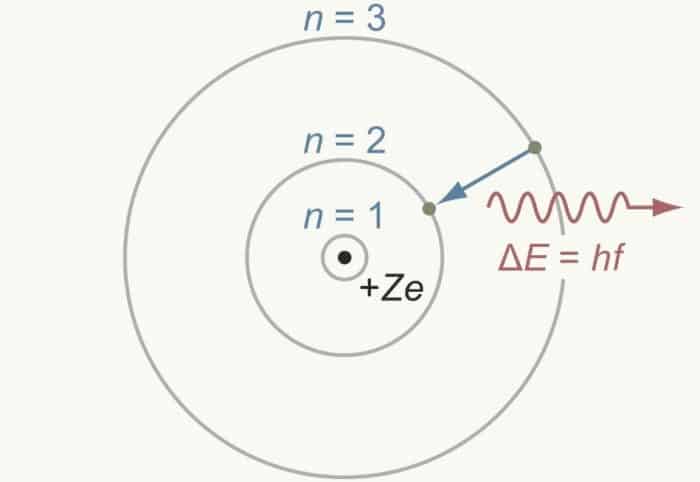
Strujtur atom ini muncul di tahun 1913, dimana dikala itu Niels Bohr mencoba untuk memperbaiki beberapa kegagalannya dalam uji coba spectrum atom hydrogen. Dalam hal ini, hasil percobaannya mengambarkan bahwa kedudukan orbit elektron menempati tempat yang ada di sekitar inti. Menurut Niels Bohr, inti atom di kelilingi oleh elektron yang mana berada pada orbit tertentu.
Namun hanya beberapa orbit yang mempunyai jumlah tertentu, antara orbit satu dengan orbit lainnya mempunyai jarak orbit sendiri dari inti atom. Tingkatan energi yang dimiliki elektron juga mempengaruhi keberadaan elektron, baik untuk orbit yang berada dalam titik rendah maupun titik yang tinggi. Hal ini juga yang menciptakan sebuah elektron yang ada di orbit rendah dan energi yang dimilikinya kecil.
Hal ini menciptakan Niels Bohr mengemukakan pendapatnya secara garis besar terhadap penelitian yang di lakukannya, yaitu:
- Elektron sendiri adalag sebuah atom yang mana memang bergerak untuk mengelilingi pada dasarnya pada lintasan-lintasan tertentu. Dalam hal ini, elektron sendiri tidak memancarkan energi dan disebut sebagai kulit atau tingkat energi elektron.
- Bukan hanya menetap, melainkan elektron sendiri sanggup berpindah dari tingkat energi yang mempunyai tingkatan yang tinggi dank e rendah disertai dengan pemancaran energi yang ada. Namun untuk perpindahan energi dari energi yang mempunyai tingkat yang rendah ke tinggi, hal ini disertai dengan perembesan tinggi.
- Elektron yang bergerak dalam hal ini pada lintasannya berada pada keadaan elektron yang tidak memancarkan energi apapun. Bukan hanya tidak memancarkan, melainkan tidak menyerap energi.
Hal ini yang menciptakan Niels Bohr mengungkapkan dan beropini bahwa elektron-elektron atom yang mana mengelilingi inti pada lintasan tersebut disebut dengan kulit elektron atau tingkat energi. Untuk tingkat energi yang paling rendah, merupakan kulit elektron yang mana terletak di bab paling dalam. Sednagnya untuk bab paling luar dan semakin keluar, mempunyai energi yang semakin besar juga.
Kelebihan struktur atom Niels Bohr:
Atom Niels Bohr mempunyai pengertian yaitu atom yang mana terdiri dari beberapa kulit untuk melaksanakan perpindahan elektron yang ada.
Kelemahan struktur atom Niels Bohr:
Salah satu kelemahan model atom ini ialah tidak sanggup menjelaskan apa itu imbas Zeeman dan imbas Strack. Hal ini juga yang menciptakan imbas ini tidak sanggup dibuktikan secara lebih jelas.
Struktur Atom Fisika Modern
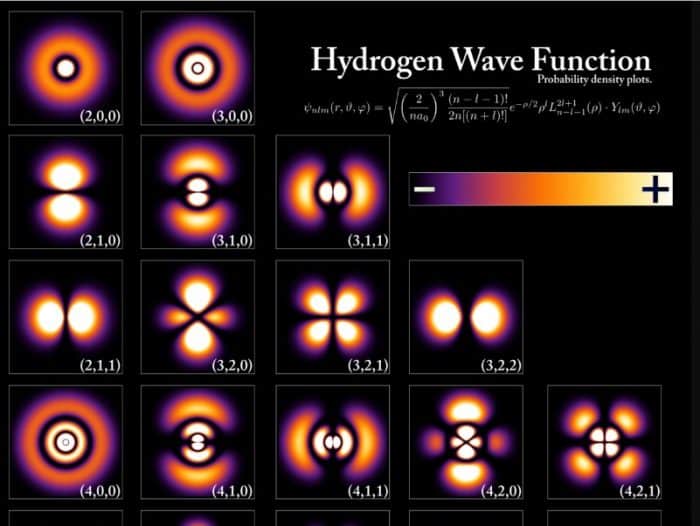
Pengertian dasar dari atom sendiri ialah atom yang memang terdiri dari elektron, proton dan juga neutron. Dalam hal ini, ada kemungkinan bahwa struktur atom yang akan dibentuk lebih sulit dan rumit alasannya lengkap mengenai bagaimana keadaan atom yang dikala ini masih dianggap belum adanya kejelasan.
Erwin Schrodinger merupakan salah seorang yang mana menjelaskan mengenao struktur atom fisika modern. Dalam hal ini sebelum Erwin, spesialis Jerman berjulukan Werner Heisenberg juga membuatkan teori mekanika kuantum yang lebih dikenal sebagai prinsip ketidakpastian.
Prinsip ini mengemukakan bahwa mustahil untuk memilih kedudukan dan momentum sebuah benda secara bersamaan, namun yang sanggup di tentukan ialah kebolehjadian suatu elektron yang mana mempunyai jarak tertentu dari inti sebuah atom. Salah satu ciri khas yang dimiliki oleh model struktur atom ini ialah mempunyai orbital lintasan elektron.
Struktur Atom Isotop
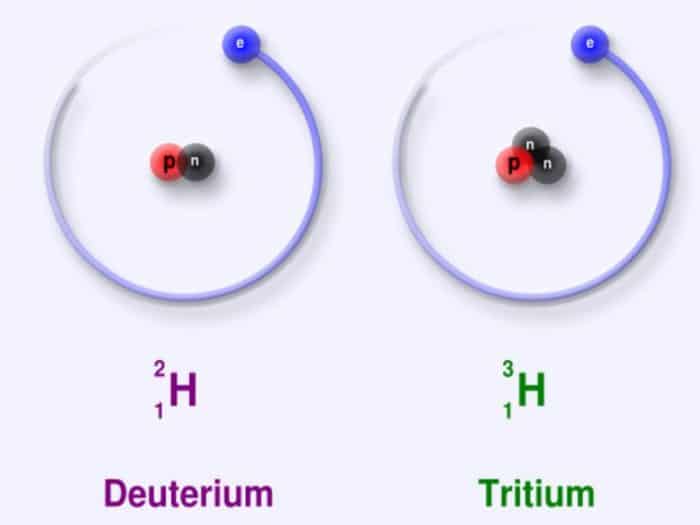
semua atom yang mana berasal dari masa atom mempunyai nomor atom yang identik. Dalam hal ini, masa yang dimiliki juga berbeda-beda. Isotop sendiri mempunyai atom-atom yang mana sama dengan nomor atom lainnya namun mempunyai perbedaan dengan nomor masa. Dalam hal ini, sanggup dikatakan jikalau semua unsur memang mempunyai alam yang berbeda, namun pada umumnya mempunyai adonan isotope-isotop.
Hal ini juga yang menghasilkan aneka macam perhitungan yang perlu diketahui rata-rata yang dimilikinya beraal dari masa-masa isotope-isotop unsur yang ada di alam. Unsur-unsur ini tentunya di dasarkan atas kelimpahan yang dimiliki oleh masing-masing isotope tersebut yang ada di alam dalam masa yang disebut masa atom.
Struktur Atom Isobar dan Isoton
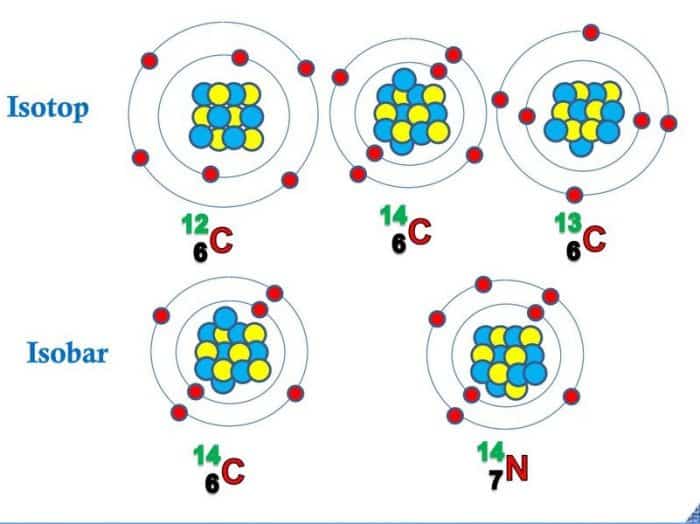
Struktur atom yang dimiliki isobar dan juga isoton mempunyai masa yang sama, namun mempunyai nomor yang berbeda. Nomor tersebutlah yang membedakan antara isobar dan juga isoton. Isobar sanggup diartikan sebagai atom-atom yang mana mempunyai nomor masa yang nama dengan isoton, namun mempunyai nomor atom yang berbeda. Dalam hal ini berbeda dengan isoton.
Isoton ialah atom-atom yang mana mempunyai jumlah neutron yang sama dengan isobar, namun mempunyai nomor atom atau unsur yang berbeda.
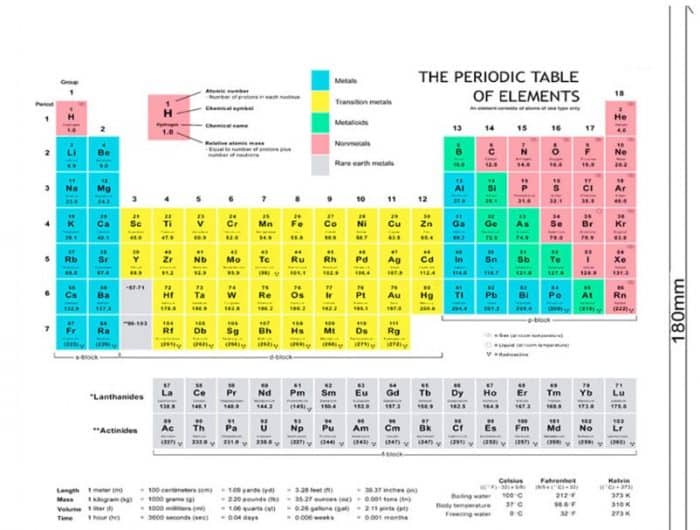
Struktur Atom dan Tabel Periodik
1. Partikel dasar yang menyusun atom
Atom sendiri sudah dikenal sebagai bab yang paling kecil dalam suatu unsur. Dalam hal ini, struktur atom juga mempunyai fungsi untuk menggambarkan bagaimana partikel yang dimiliki oleh atom sanggup di susun. Nantinya atom akan tersusun dari inti atom bahkan hingga elektron yang memang mengelilingi atom tersebut. Elektron itu nantinya akan tersebar di kulit atom.
Sebagian besar untuk atom sendiri juga terdiri dari aneka macam ruang hampa. Di dalam ruangan hampa tersebut mempunyai inti yang ukurannya sangat kecil, dimana masa dan juga muatan positif yang dimilikinya akan dipusatkan dan juga di kelililingi oleh elektron yang mempunyai muatan negatif. Inti atom sendiri terdiri dari proton dan juga elektron yang mempunyai muatan yang berbeda.
Ketiga partikel yang dimiliki oleh atom, yaitu proton, neutron, dan elektron dikenal dengan lambang :
– X : untuk lambang suatu unsur
– Z : Nomor atom
– A : nomor masa
Itulah citra yang ada dalam table periodic.
2. Susunan dari sebuah atom
- Cobalah untuk melihat nomor yang terdapat pada table periodic. Dalam hal ini, anda sanggup melihat tanda yang sebelumnya sudah dijelaskan. Nomor atom mempunyai nomor yang selalu lebih kecil dibandingkan dengan nomor masa.
- Dalam hal ini, nomor atom ialah bentuk dari jumlah proton. Hal ini dikarenakan sifat atom yang netral, maka nomor atom juga merupakan jumlah dari elektron yang ada.
- Cobalah perhatikan susunan-susunan elektron yang ada dalam level-level enetrgi yang ada. dalam hal ini, selalu isi level yang berada paling dalam akan mengisi bab yang paling luar.
- Perhatikan selalu bahwa jumlah tingkatan elekron yang paling luar dalam table periodic akan sama dengan nomor golongan yang memang mempunyai dua elektron.
Sedikit gosip mengenai struktur atom yang sanggup anda jadikan sebagai suplemen ilmu. Struktur atom mempunyai beberapa model dan juga sanggup anda temukan dengan gampang memakai alat bantu, yang biasa dikenal sebagai table periodic. Struktur atom sendiri beragam, anda sanggup mempelajarinya lebih dalam lagi dan mengerti untuk setiap modelnya. Semoga goresan pena yang kami buat ini cukup membantu anda dalam memahami fisika atau khususnya struktur atom.
Boleh copy paste, tapi jangan lupa cantumkan sumber. Terimakasih


Komentar
Posting Komentar